1 简述
营养级联效应是调控全球水生和陆生生态系统中群落结构和丰度的重要机制。目前,理解全球环境变化如何影响营养级联强度成为生态学研究中主要的挑战之一。为此,我们整合了全球161 个实验位点的数据,分析了多重因素是如何影响全球淡水生态系统中鱼类的营养级联效应。鱼类对浮游动物和水体透明度具有显著的负面影响,但对水体生产者和养分有促进作用。此外,鱼类营养级可以改变营养级联的强度,但偶数链对自然生态系统的生产者未产生负面影响。富营养化、变暖和捕食者丰度会强化对浮游植物的营养级联效应,表明在未来全球变化背景下,下行效应将变得越来越重要。我们的研究结果发现,随着纬度的增加,营养级联强度未受影响甚至增加(如对浮游植物),这并不支持此前营养级联强度在赤道附近增加的普遍观点。随着时间和空间尺度的增加,实验的持续时间对营养级联强度具有累积影响,而实验区域的大小则无显著影响。总之,富营养化、变暖、时间尺度以及捕食者营养级水平和丰度等多重因素对营养级联强度的影响至关重要,未来的研究应注重多重因素对食物网络结构和动态的可能的协同效应。
2 引言
营养级联,即捕食者通过食物网跨越多个营养级向下传播的效应,在生态系统的结构和动态中发挥着至关重要的作用(Ripple et al. 2016)。在淡水生境中,凶猛鱼类(piscivorous fish)已被用于湖泊修复的水质改善,这是因为鱼类捕食行为可导致对低营养级和环境产生强烈的级联作用(Hansson et al. 1998)。最近的研究表明,这种营养级联作用受到人为活动的影响,例如过度捕集、物种入侵、污染和栖息地丧失,最终改变生态系统的功能和服务 (Estes et al. 2011, Jackson et al. 2001)。例如,过度捕捞会改变物种组成,扭曲食物网,甚至引起生态系统在极端条件下转向另一种状态(Daskalov et al. 2007, Jackson et al. 2001, Scheffer et al. 2005)。营养级联的强度还受到生态系统类型、生产力、初始扰动程度、环境条件、生物特征(例如体型和代谢率)和响应变量的影响(Borer et al. 2005, Jia et al. 2018, Pace et al. 1999, Strong 1992)。此外,食物网的动态不仅依赖于下行效应的强度,还取决于资源的上行效应。据推测,鱼类可以通过排泄 (Attayde and Hansson 2001, Vanni and Layne 1997)和沉积物再悬浮(Scheffer et al. 2003)加速营养循环。因此,在人类干扰的背景下,阐明捕食者的净级联效应及其决定因素对生态系统管理具有重要的指导意义。
营养级联假说认为,对初级生产者的营养级联取决于食物链的长度,奇数营养级增加生产者的现存量,而偶数营养级会由于初级消费者的增多会减少生产者的丰度(Fretwell 1977, Ripple et al. 2016)。例如,在浮游植物-浮游动物-浮游动物食性鱼类-凶猛鱼类食物链中,对浮游动物食性鱼类的捕食减轻了对浮游动物的取食压力,这将增加了对浮游植物的取食压力 (Eriksson et al. 2009, Hansson et al. 1998)。然而,在自然生态系统中,由于鱼类食性复杂,鱼类很少具有完全偶数或奇数的营养级,这可能弱化下行效应(Attayde et al. 2010)。一些研究表明,由于食物网较大的复杂性,杂食性消费者可能会削弱营养级联的强度(Fagan 1997, Polis and Strong 1996)。有证据显示,杂食性消费者的增加有利于初级生产者,并产生强烈的级联效应,这是因为其优先以动物为食,而不是植物(Ho and Pennings 2008)。然而在淡水生态系统中,杂食性的滤食鱼类可以直接利用初级生产者,因此在一些亚热带富营养化水体中这些鱼类被用于藻类水华的控制和水质的改善(Zhang et al. 2008)。因此,我们目前对天然淡水生态系统中营养级联强度如何随营养级(如植食性、浮游动物食性和肉食性鱼类)变化的认知仍然不足。
理解下行调控的另一个主要挑战是确定营养级联效应是否会因人为压力放大或削弱,例如富营养化和气候变暖(Piovia-Scott et al. 2017, Rosenblatt and Schmitz 2016)。众所周知,富营养化诱导的高资源可用性和质量能支持更多的消费者,这将通过促进植食动物的消费进而增加级联效应(Leibold 1989)。一项对海滨湿地的meta分析表明,富营养化通过增加叶片的氮浓度增强了植物与牧食动物的相互作用(He and Silliman 2015)。然而,富营养化也会影响初级生产者的群落结构和动态(Su et al., 2019),这可能会改变消费者的食物组成,从而降低营养级联效应的强度。营养富集还会通过降低食物网络效率来阻断捕食者与猎物的相互作用(Davis et al. 2010),例如,富营养化促进水体中有毒的和低可食性的抗捕食藻类的增加(Heisler et al. 2008)。简而言之,营养级联的强度可能因生态系统的营养盐水平而变化。
全球变暖也可能改变食物网对营养级联效应的敏感性。由于异养生物的呼吸速率比自养生物光合速率对温度更加敏感(Allen et al. 2005),因此在较温暖的条件下,鱼类较高的代谢率可能导致摄食率提高,对低营养水平产生更强的下行影响。然而,温度过高可能会对有机体的适应产生负面影响,并限制摄食率(Deutsch et al. 2008),这反过来又会削弱营养级联的强度。此外,变暖以及鱼类捕食往往会降低牧食性浮游动物的大小 (Brooks and Dodson 1965, Forster et al. 2012, Daufresne et al. 2009, Yvon-Durocher et al. 2011),这可能导致对初级生产者下行效应的减弱(Delong et al. 2015)。研究表明,由于捕食者较小,在(亚)热带湖泊中的鱼类操纵效率要低于温带湖泊(Jeppesen et al. 2005)。气候变暖有利于蓝藻的繁殖,从而降低浮游动物的食物质量,因此减弱下行效应(Paerl and Huisman 2008)。变暖还可能通过促进富营养化增强上行效应,例如,极端天气导致的营养负荷升高可增加养分矿化和蒸发以及沉积物的营养释放 (Gudasz et al. 2010, Jeppesen et al. 2009)。气温升高还可能导致鱼类捕食更多的富碳资源和排泄多余的营养物质,以保持呼吸作用的增加(Hessen and Anderson 2008)。处于不同营养级的鱼类对温度的敏感性可能有所不同(Vasseur and McCann 2005),这导致对低营养级不平衡的级联效应。例如,浮游植物和藻类水华在奇数营养级水生生态系统中受益于气候变暖,而在偶数数量营养级系统中不会如此(Hansson et al. 2013)。因此,养分和消费者-资源相互作用的温度依赖性会影响藻类的生物量。
天然淡水生态系统中鱼类放养是一种广泛而长期的人类活动,能影响全球生态系统的功能和服务(Eby et al. 2006, Hammerschlag et al. 2019, Su et al. 2020)。在本研究中,通过对全球161个地点2202个观测数据进行了meta分析,旨在阐明鱼类放养对浮游动植物和水质的净营养级联效应,量化营养级、富营养化和全球变暖如何影响营养级联的强度。此外,目前关于下行效应强度的纬度格局暂未定论,我们评估了下行级联效应的强度是否随纬度变化而变化。本研究也评估了捕食者丰度(鱼类密度)、实验大小(体积)和实验时间尺度(实验持续时间)是否与营养级联效应有关。
3 材料和方法
3-1 数据源和收集
在科学网(Web of Science)和中国知网(CNKI,http://www.cnki.net)(1900-2020年)搜索了与鱼类操纵有关的同行评议文章。使用的文献搜索关键词是鱼和exp*和(浮游生物或浮游植物或藻类*)。此外,已发表的关于淡水生态系统鱼类操纵的综述和meta-分析也被选为补充研究(Bell et al. 2003, Brett and Goldman 1996, Zhang et al. 2008)。然后,我们根据以下标准筛选了研究:(一) 至少报道一个响应变量,即 总氮(TN)、总磷(TP)、水体透明度(Secchi 深度,SD 表示)、叶绿素 a (Chla)、总浮游植物(生物量或丰度,下同)、总浮游动物、枝角类、桡足类、和轮虫;(二) 有鱼和无鱼处理必须同时开始,但排除了以湖泊生态修复为目的进行鱼类操纵的研究;和(三)只包括淡水鱼的实验。
根据上述标准,本研究从 206 篇已发表的论文中收集了 161 个站点 2202 个单独观测数据(详情请参阅附录 S1)。站点主要分布在北美、欧洲和东亚(图1)。对每一条数据,记录实验的位置、实验体积(m3)、鱼的物种名、实验持续时间(天)、鱼类放养密度(g m-3)和水温(°C)等信息。如果鱼类密度信息是个体数量或体长,则根据 FishBase(https://www.fishbase.cn/search.php)中相应物种的长度重量关系来计算鱼的质量。同样在该网站,基于食物成分对放养鱼类的营养级位置进行评估。如果鱼类处理包括多个物种,则使用平均营养级水平。基于营养水平将鱼类分为三组,即2.0-2.5、2.5-3.5和3.5-4.5,分别代表植食性鱼、浮游动物食性鱼和肉食性鱼类。由于鱼类在不同时期的觅食习惯可能截然不同,因此,当研究使用幼鱼进行实验时,将该鱼类划分为浮游动物食性鱼类。如果未报道单独观测的水温,则使用实验的平均水温。此外,本研究也分别收集了浮游动物和浮游植物的生物量和丰度数据。

图1 本研究收集的161个鱼类操纵实验的站点分布
本研究从表格和文本中直接提取数据,或使用 GetData 软件(版本 2.25)从图中间接提取,同时提取了对照组和处理组中每个响应变量的平均值、标准差和样本量。如果未报道标准偏差,则通过将标准误乘以样本量的平方根计算。
3-2 统计分析
利用自然对数转换响应比(LRR,The natural log-transformed response ratio)来衡量效应量(Hedges et al. 1999),响应比计算如下所示:
LRR = ln (Xt/Xc)
其中Xt是实验组均值,Xc是对照组中的平均值。每个个体效应量的方差(υ)计算如下:

其中nt和nc分别是实验组和对照组的样本量,St和Sc分别是实验组和对照组的标准偏差。对于每个监测点,我们使用 R 包" metafor "包中" escalc "函数计算效应大小(Viechtbauer 2010)。采用方差加权混合模型估计了实验组的平均效应大小(LRR++),置信区间(CIs)设置为95%。如果 95% 的 CIs 不包含零,则加权平均效应大小显著。此外,利用多重比较(Fisher's Least Significant Difference, LSD)来测试不同摄食习惯鱼类之间响应变量的差异。为了方便解释,加权效应大小被转换回百分比变化(percentage change (%)),计算方式如下:
![]()
对于每个响应变量,使用具有随机效应的多层次混合模型来探究研究之间的差异。其中,将不同研究设置为随机效应,以减少数据的潜在依赖性(Cauvy-Fraunié and Dangles 2019, Nakagawa and Santos 2012)。此外,数据通常会嵌套在更高层次的单元中。例如,在本研究中,不同的鱼类处理方法往往嵌套在同一研究中。因此,我们使用分层随机效应来研究营养级联强度的潜在驱动因素,将鱼种处理作为随机效应嵌套在研究中。首先,使用随机效应模型来评估总体响应。然后,使用混合效应Meta回归,包括TN、TP、温度、鱼类的摄食习性、绝对纬度、鱼密度、实验体积和实验周期作为每个响应变量的固定因素(调节变量)。当 LRR 和回归系数均显著正相关或显著负相关时,该因素被认为会放大营养级联的强度。进一步用 Q-统计评估了效应量的异质性,以评估模型是否能解释显著数量的变异。对于Meta回归,总异质性可分为调节变量(Qm)解释的方差和残差方差(Qe)。Qm-统计是模型系数的Wald型测试。显著的Qm统计表明调节变量贡献了效果量的异质性(Viechtbauer 2010)。为了测试每个变量中潜在的研究偏差,使用了Egger回归建立了效应量与其标准误差之间的回归关系(Egger et al. 1997)。在无研究偏差的情况下,加权回归斜率预计将为零。使用Trim and fill方法识别和调整研究偏差(Duval and Tweedie 2000)。我们通过比较了多层随机效应、简单随机效应和Trim and fill方法的结果,以评估结果是否有差异(Appendix S1: Table S1)。R 软件中的" metafor "包用于执行这些分析(Viechtbauer 2010)。
为评估多重因子对营养级联强度的相对重要性,采用Akaike信息准则(AIC)进行多模型评估。此方法通过基于AIC的所有可能组合来进行模型选择,某一特定因素的重要性表示为所有包含该因子模型的权重之和。该方法允许在模型中存在固定效应和随机效应,被广泛应用于Meta分析(e.g., Feng and Zhu, 2019; Civitello et al., 2015; Crawford et al., 2019; Deng et al., 2018)。使用R软件中的"glmulti"包完成上述分析。
4 结果
对整个数据集的Meta分析表明,鱼类的引入对TN(LRR++= +0.18,p< 0.001:增加19.6%)、TP (LRR)++= +0.21,p< 0.001:增长23.4%)、Chla(LRR++= +0.54,p< 0.001:增加71.7%)、浮游植物生物量(LRR)++=0.60,p< 0.001:增长82.6%)和轮虫生物量(LRR++= +0.57,P< 0.001:增长76.1%)有显著的正影响,但对水体透明度(LRR++=-0.19,p< 0.001:下降17.3%)、总浮游动物生物量(LRR++=-0.76,p< 0.001:下降53.0%)、枝角类生物量(LRR++=-1.57,p< 0.001:下降79.1%)和桡足类(LRR++=-0.70,p< 0.001:下降50.2%;Appendix S1: Table S2) 有负影响。此外,偶数营养级(植食性和肉食性)鱼类对初级生产者有显著的正影响(Fig. 3d,e and Appendix S1: Table S3)。与植食性和肉食性鱼类相比,浮游动物食性鱼类对TN、TP、水体透明度和Chla的营养级联效应更强。总浮游动物和桡足类浮游动物均对植食性鱼类表现出最强烈的负响应(Fig. 3f,h),表明一些植食性鱼类(herbivorous)也可给浮游动物施加胁迫。

图2 TN(a)、TP(b)、透明度(c)、Chla(d)、浮游植物(e)、总浮游动物(f)、枝角类(g)、桡足类(h)和轮虫(i)对鱼类下行效应的响应。按递增的顺序显示每个样品的效应值和95%信置区间。红色表示效应值的显著负相关,蓝色表示正相关,灰色表示无相关。LRR++ 为平均效应值(加权响应比),s为SE。频度分布图为负相关和正相关样品的数量。黄色代表生物量数据,绿色代表密度数据。
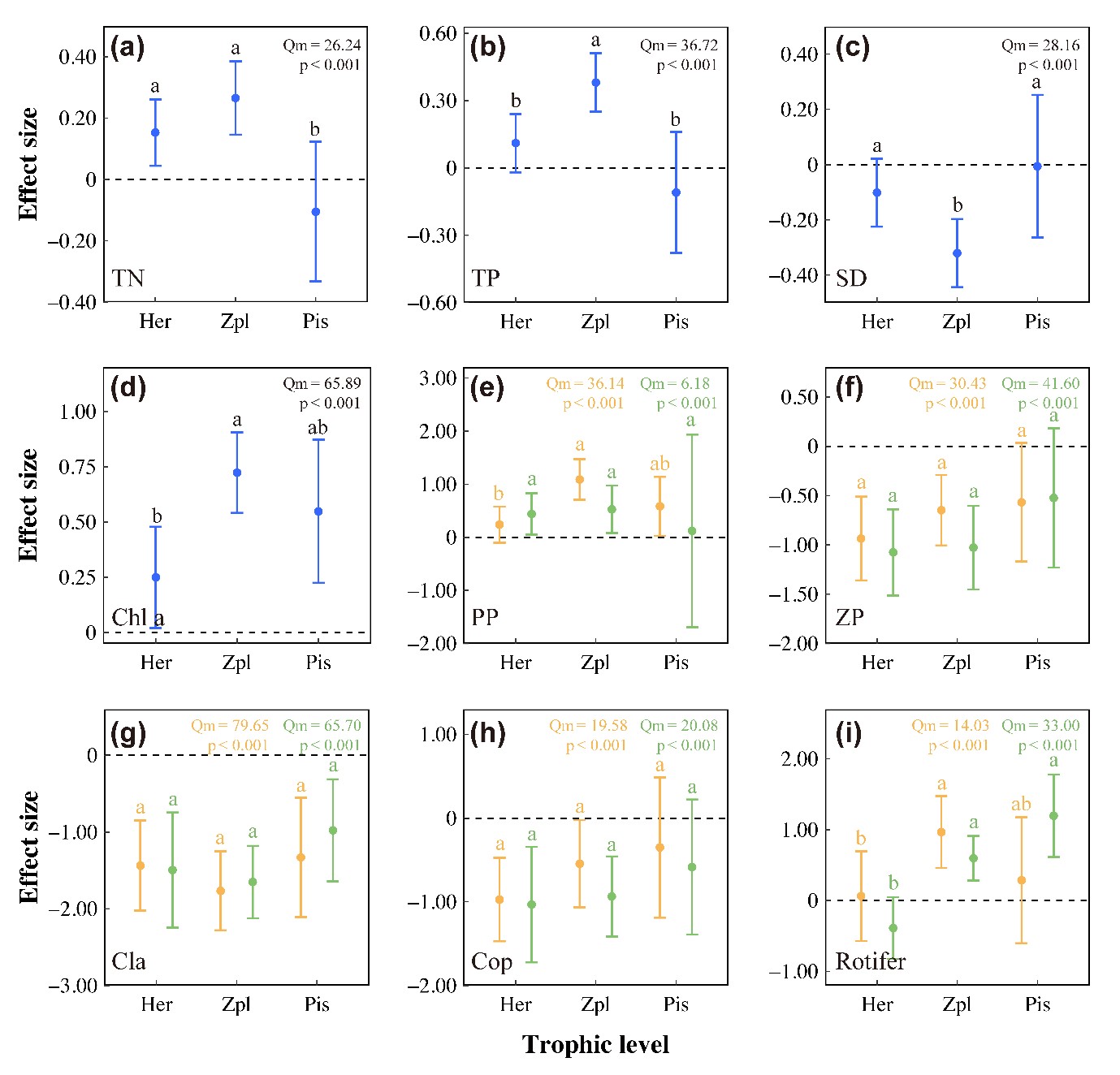
图3 不同摄食习性鱼类引入的加权响应比。误差代表加权响应比的95%信置区间(CIs)。a、b、c代表不同摄食习性鱼类组间的显著差异。Her,杂食性;Zpl,浮游动物食性;Pis,肉食性;TN,总氮;TP,总磷;PP,浮游植物密度;Chl a,叶绿素a;ZP,总浮游动物密度;Cla,枝角类密度;Cop,桡足类密度(以下同)。黄色表示生物量数据,绿色表示密度数据。
实验背景营养盐水平与LRR-浮游植物的生物量和丰度正相关(Fig. 4 for TN and Appendix S1: Fig. S1 for TP),表明富营养化放大了对浮游植物的营养级联效应。营养盐对浮游动物营养级联强度有负面影响(TN为0.018,TP为0.001,而对不同类群浮游动物的营养级联强度显示出对富营养化的不同响应。LRR-枝角类与 TN 和 TP 呈正相关,而LRR-桡足类和LRR-轮虫则表现出负相关,这表明富营养化放大了对桡足类的营养级联强度,但抑制了对枝角类和轮虫的营养级联强度。
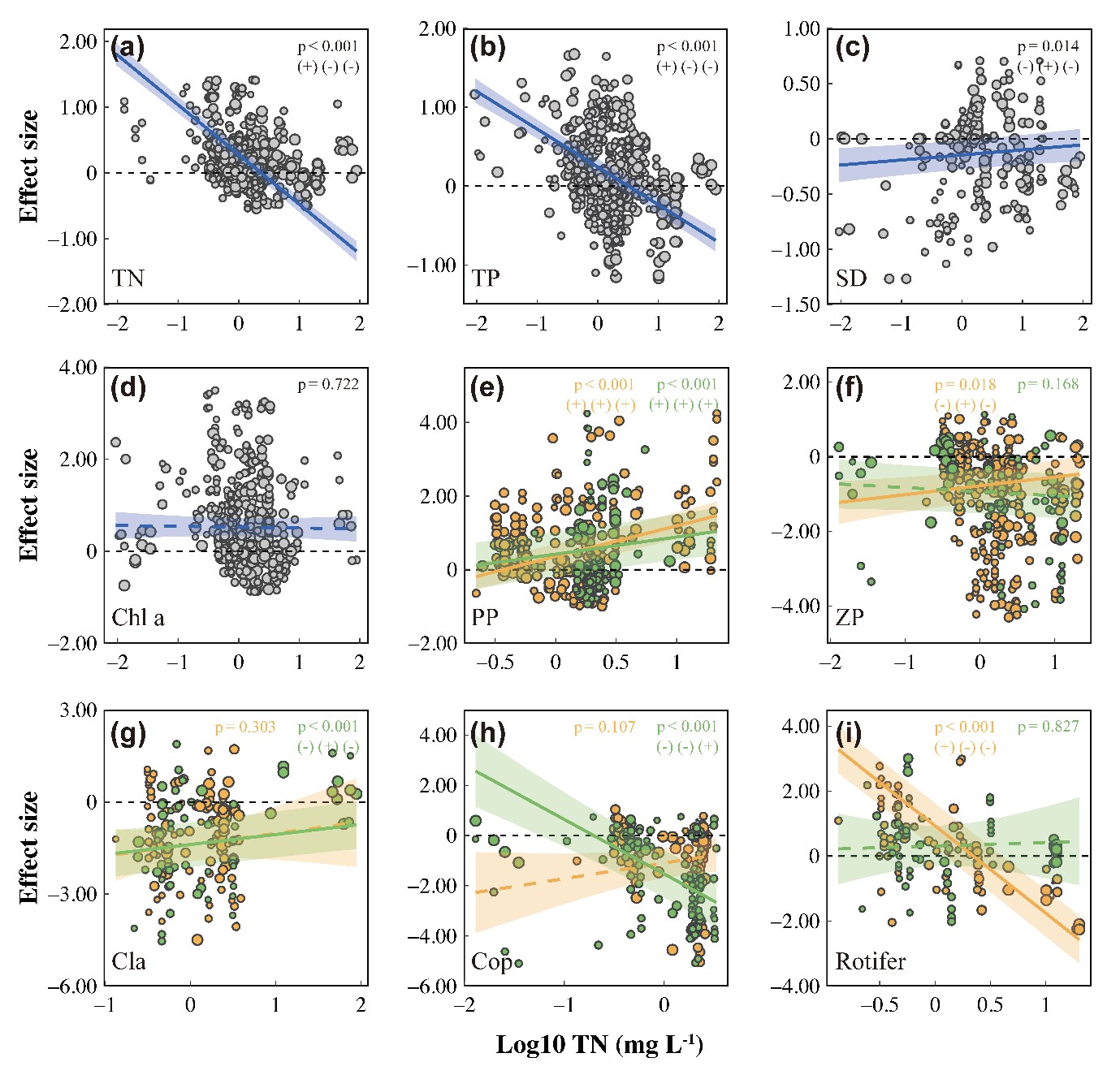
图4 基于混合效应meta-回归分析总氮对下行效应的影响。图中点大小根据其1/SE成比例绘制用实回归线以及95%信置区间表示显著的变化趋势(p < 0.05),而虚线表示不显著的趋势。(+/-)(+/-)(+/-)分别表示对鱼类引入的正/负响应、随总氮(或其它因素)增加的正/负关系,以及营养级联程度的增强/减弱(以下同)。黄色表示生物量数据,绿色表示密度数据。
混合效应回归分析显示实验温度与对TN、TP、水透明度、Chl a、总浮游动物、枝角类和轮虫生物量的效应值间存在强正相关关系(all p < 0.001; Fig. 5 and Appendix S1: Table S4),表明变暖放大了营养级联效应。纬度与LRR-浮游植物的生物量(p = 0.002)和丰度(p = 0.029)均具有显著的正相关关系,而与浮游动物和水质无显著相关关系(Appendix S1: Fig. S2)。
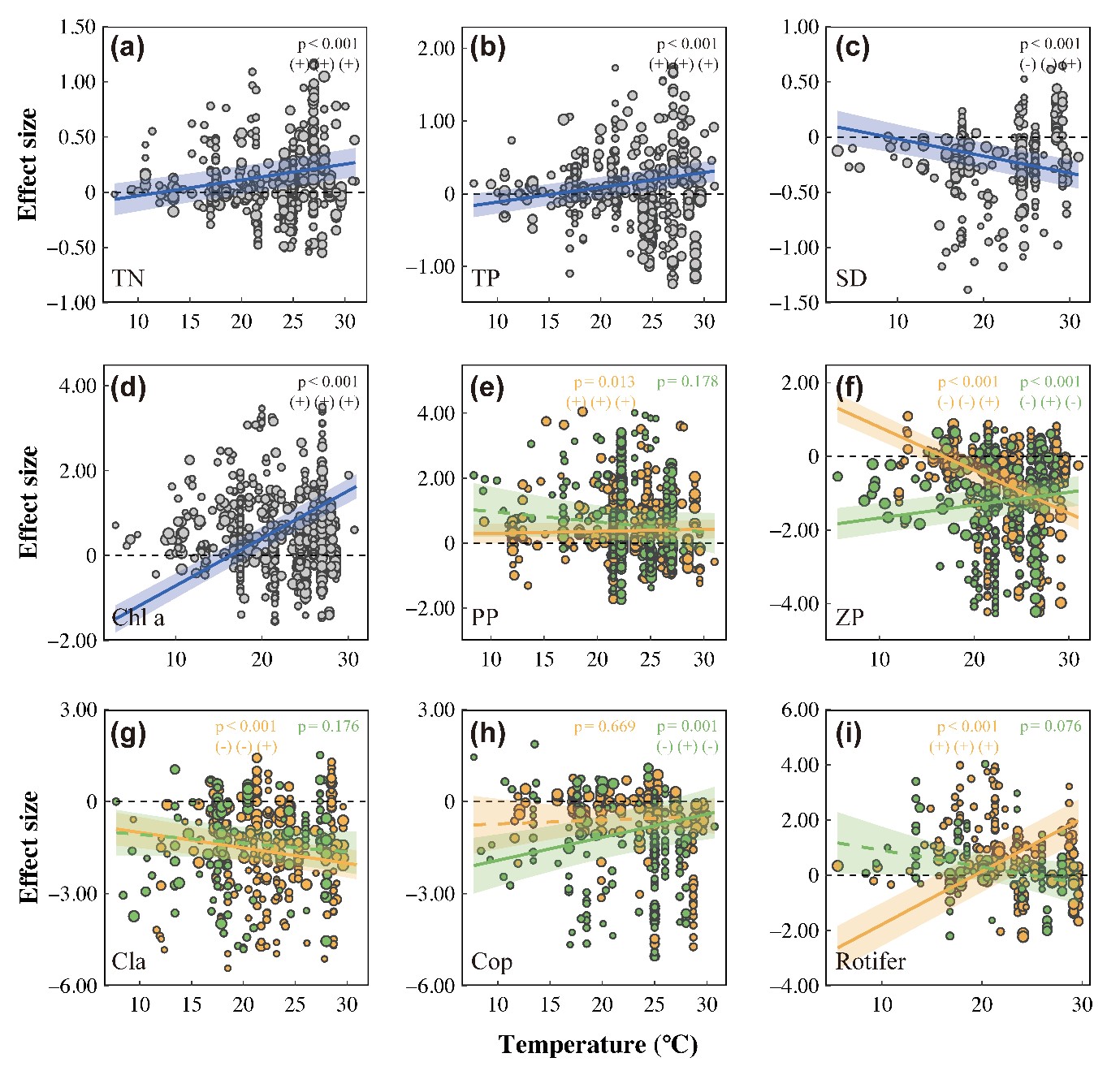
图5 温度对鱼类捕食引起的营养级联强度变化的影响
鱼类丰度显著增加了TN、TP、 Chl a、浮游植物生物量和浮游动物生物量的营养级联效应(all p < 0.001; Appendix S1: Fig. S3 and Table S5),表明在鱼类密度高的实验中,营养级联发生了更大的变化。本研究还评估了级联效应大小是否随着空间和时间尺度增加而变化,例如,效应值是否由于累积效应随着实验持续时间的延长而增加,以及是否由于实验体积的增大而导致生境异质性的增加而减少。实验持续时间与TN、TP、水体清澈度、Chl a和浮游动物总生物量的响应值呈显著的正线性关系(all p < 0.001; Appendix S1: Fig. S4)。此外,实验持续时间增加了对枝角类生物量的营养级联级(p = 0.013),但降低了枝角类丰度的响应值(p < 0.001; Appendix S1: Fig. S4)。实验尺度大小与对水质、枝角类、桡足类和轮虫的效应值无关,说明实验的空间尺度对营养级联强度的影响较弱(Appendix S1: Fig. S5 and Table S5)。
5 讨论
本研究的Meta分析整合了全球相关实验的研究数据,为证明鱼类放养对浮游动物、浮游植物、营养盐和水体透明度施加了广泛的下行级联效应提供了强有力的证据。利用206项研究的2202个实验观测结果,本研究代表了迄今为止最全面的评估,涉及鱼类引入对较低营养级生物和水质的影响是如何受多种因素的调控。特别是,鱼类操纵对浮游动物和水体透明度有负影响,但对浮游植物和养分循环有正影响(图6)。综合分析显示,与此前淡水(Brett and Goldman 1996)、陆地(Jia et al. 2018, Schmitz et al. 2000)和海洋浮游生物生态系统(Shurin et al. 2002)相比,本研究的营养级联更加强烈。此外,浮游动物的响应因类型而异。枝角类和桡足类对鱼类放养呈现负响应,而轮虫则为正响应。由于枝角类的身体体型一般较大,行动能力较弱,我们的结果表明,枝角类比桡足类对鱼类捕食更为敏感。
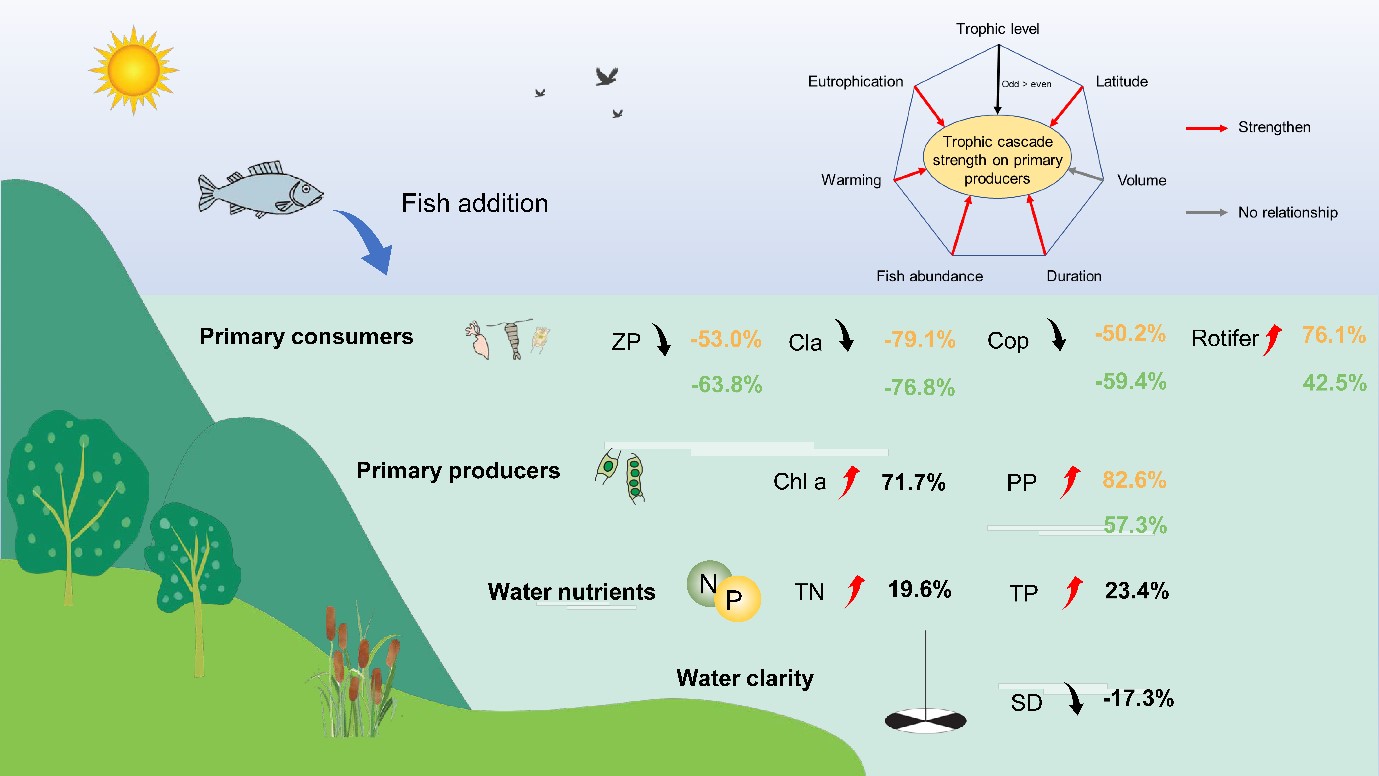
图6 淡水生态系统中营养级联效应及可能的影响因素。数字代表加权的百分变化,颜色代表生物量(黄色)和密度(绿色)。鱼类添加对低营养级消费者、初级生产者和水质的正、负效应分别用向上的红色箭头和向下的黑色箭头表示。图的上半部分表示多因子是如何影响对初级生产者的营养级联强度。红色表示能增加营养级联强度的因子,而灰色表示无相关性。ZP,总浮游动物密度;Cla,枝角类密度;Cop,桡足类密度;PP,浮游植物密度;Chl a,叶绿素a;TN,总氮;TP,总磷;SD,透明度(用水的清晰度表示)
营养级联理论认为,初级生产者的响应是由食物链长度决定的,藻类生物量将在三营养级而不是二或四营养级系统中受益(Fretwell 1987, Hansson et al. 1998)。我们的结果证实,在不同营养级鱼类处理具有显著不同的对浮游植物的营养级联强度。进行植食性(浮游植物食性)鱼类或凶猛鱼类操纵的生态系统通常比浮游动物食性鱼类操纵的生态系统具有更低的藻类生物量和更好的水质。然而,我们的结果也表明,食物链长度并不总是初级生产者正/负响应的决定性因素。例如,植食性鱼对TN和Chl a有正影响,这表明通过引入植食性鱼类的操作不能抑制浮游植物的生长。相反,由于一些植食性鱼类是没有特定食物选择的机械性滤食者,这些鱼对浮游动物有负面影响,特别是对大型枝角类(Fig. 3f,g)。现实观察和理论预测之间的不一致可能是由于这些鱼类在自然界中表现出的杂食特性(Attayde et al. 2010)。由于本研究中实验鱼的饵料包括植物、腐屑、浮游动物、底栖动物和鱼类,与常用的理论模型(Hansson et al. 2013)相比,鱼类营养水平不是一个离散的整数。此外,摄食习性通常是灵活的,并可能随鱼的个体发育过程而改变(Werner和Gilliam 1984),这将进一步削弱现实生态系统中食物链长度的级联效应。
上下行效应的相对强度对初级生产者生物量的影响在生态学研究中备受关注。早期研究表明,下行控制在淡水和海洋生态系统中比在陆地生态系统中更有影响(Gruner et al. 2008, Shurin et al. 2002)。由于上下行力量是相互依存的,资源水平可能会增强或抑制下行控制效果。水质(TN,TP和SD)在相对贫营养条件下对鱼类添加更为敏感(Fig. 4a,b,c)。此外,富营养化是对浮游植物生物量和丰度下行级联效应的最重要预测因子(Appendix S1: Fig. S6 and S7)。富营养化放大了营养级联,这与营养盐富集强烈地增加了盐沼动物的牧食性相一致(Bertness et al. 2008, He and Silliman 2015)。富营养化总体上降低了对浮游动物的营养级联强度,这可能是由于捕食者的视力降低和浮游动物的高食物资源可利用性。此外,富营养化放大了桡足类动物的响应,但减小了枝角类和轮虫的响应,表明在不同浮游动物类群中,营养级联强度对富营养化的响应不同。
本研究结果表明,温度升高显著放大了对淡水生态系统低营养级生物的生物量和养分的营养级联强度(Fig. 5)。这些发现对于理解全球变化背景下气候变暖对下行效应的影响具有重要意义。营养级联的强度预计也会随着纬度和气候梯度的变化而变化,在低纬度和较温暖地区的下行控制作用更强(即纬度生物相互作用假说,LBIH) (Reynolds et al. 2018, Rodriguez-Castaneda 2013, Roslin et al. 2017)。然而,在扩展这些结果到空间分布时应该谨慎。有研究显示,气候变暖加强了寒冷地区的下行控制,但在温暖地区则减弱了下行控制(Marino et al. 2018)。另外,也有研究表明,下行控制可能具有地点特异性,并受当地实验环境的调节,因此没有明确的地理格局(Jia et al. 2018, Moles et al. 2011)。在本研究中,浮游植物的生物量和丰度都向高纬度地区表现更强的下行控制(Appendix S1: Fig. S2),这与LBIH的预测相反,但与在温带地区的鱼类操纵比在(亚)热带地区效率更高的经验一致(Lazzaro 1997)。这一结果表明,下行控制的地理格局不仅取决于当地温度,而且与其他生物因素(如捕食者的丰度、体积、食物质量、生物多样性和杂食性)有关(Marino et al. 2018)。例如,增加鱼类丰度可显著增强对低营养级的营养级联效应强度。热带地区通常拥有较少的大型甲壳类动物,更多的过滤性杂食动物,以及更频繁的群体捕食,这可能削弱下行生物相互作用。因此,在更大的空间尺度上,消费者与资源相互作用的强度受到捕食-防御权衡(Piovia-Scott et al. 2017)的约束,这与长期进化适应了当地栖息地特征有关。
空间和时间尺度是任何实验设计中都需要面对的一个问题。本研究的结果表明,随着实验体积增加下行控制未呈现显著差异或一致变化,而实验持续时间显示了与营养级联强度的强正相关关系(Appendix S1: Fig. S4 and Fig. S5)。我们的结果不支持先前的假设:栖息地面积越大,空间异质性的增大(例如,为消费者提供庇护),降低了捕食者的觅食效率或空间资源补偿较低(Borer et al. 2005, McCann et al. 2005, Shurin et al. 2006, Leroux and Loreau 2008)而降低营养级联强度。随着时间尺度增加,营养物质、浮游植物和总浮游动物显现出累积效应,而枝角类的丰度则呈现下降的趋势。事实上,很多的研究发现,鱼类可在短时间内对低营养级生物和非生物环境因素产生显著影响(≤1周)(Figueredo and Giani 2005, Gu et al. 2016, Wasserman et al. 2015)。枝角类在长时间尺度内可能会表现出适应性进化,使它们能够抵抗下行效应。例如,滤食性鱼类更喜欢取食大型浮游生物,导致小型枝角类的进化,进而降低鱼类捕食效率。
6 结论
本研究通过全球Meta分析,评估了淡水生态系统中营养级联的强度。相较于此前报道的海洋和陆地食物网(Jia et al. 2018, Schmitz et al. 2000, Shurin et al. 2002),淡水生态系统中的营养级联有更强的响应。捕食者营养级可显著改变低营养级生物的响应、水体营养盐和透明度。然而,在本研究结果不支持偶数链长度将导致初级生产者减少的预测,这可能是由于淡水生态系统中的鱼类杂食性所致。水质(TN、TP和透明度)对鱼类操纵在相对贫营养条件下较富营养条件下更为敏感。此外,我们发现富营养化和变暖会显著增加对初级生产者营养级联强度,这对预测未来全球变化下的食物网络的动态具有重要意义。本研究结果也显示,对浮游植物的下行级联效应强度随纬度的增加而增加,并不支持营养级联通常在靠近赤道的地方更加强的普遍认识。此外,生境大小并没有改变营养级联的强度,但捕食者的丰度和实验持续时间与营养级联的强度呈正相关。本研究为淡水生态系统富营养化、气候变暖、纬度、捕食者丰度和营养级、实验规模和持续时间对营养级联强度的影响等方面提供了新认识。未来需要同时对多种因素进行更多的实证研究,对营养级联的进一步研究应侧重于评估多种因素可能产生的加和效应、协同效应或拮抗效应。
该研究近日发表于Ecology(Su HJ, Feng YH, Chen JF, Chen J, Ma SH, Fang JY, Xie P. 2021. Determinants of trophic cascade strength in freshwater ecosystems: a global analysis. Ecology),苏豪杰为论文第一作者,谢平研究员为论文的通讯作者。该研究得到国家自然科学基金重大研究计划培育项目( 91951110)和中国科学院战略性先导科技专项(B类)(XDB31000000)等的资助。