摘要
1. 随着人类活动的加剧,各种生态系统发生稳态转换的案例都在快速增加。 因此,了解和预测稳态转换是生态学中的关键挑战。 已有的研究主要集中在单一环境驱动因素(例如富营养化)和系统崩溃之前的预警信号(EWS)。 但是,目前尚不清楚多种环境胁迫因素如何相互作用以塑造生态行为,以及在湖泊生态系统恢复之前是否可检测到预警信号。
2. 在气候变暖,富营养化和鱼类放养的综合压力下,我们发现了武汉东湖生态系统突变和时滞的经验证据。该稳态转换在64年的多营养级水平的长期监测和古硅藻记录中得到了交叉验证。
3. 我们的研究表明,在系统崩溃和恢复之前均可以检测到预警信号,并且包含个体大小信息的复合预警指标需要更短的时间序列数据,并且可以提高稳态转换的预测能力。尽管我们尚未观察到生态系统完全恢复,预警信号为我们采取措施恢复到清水状态提供了机会。
4. 气候变暖和下行效应通过改变浮游动植物的丰度和个体大小降低了水体透明度,进而对大型植物的丰度产生负面影响。 此外,我们发现稳态转换后,主导驱动因素由上行效应转变为下行效应,使营养物质与生物成分之间的关系解偶联,从而降低了养分削减的功效。
5. 综合 本研究对多胁迫因素的时滞有了新的认识,并提高了我们对自然淡水生态系统崩溃和恢复过程中基于性状的预警信号的理解。对于管理实践而言,我们的工作表明,减缓气候变暖,减弱鱼类对食物网的捕食压力,是提高湖泊恢复中营养削减效果的必要条件。
前言
大量文献表明,生态系统(淡水、海洋和陆地)对环境驱动因素的响应是非线性的。当一个驱动因素超过阈值时,就会发生突变(Beisneret al., 2003;Scheffer et al., 2001),即使外部驱动因素恢复到以前的状态,生态系统也常常难以恢复(即时滞)。时滞不仅导致生态功能和服务的严重退化,而且会给恢复实践带来困难(Hilt et al., 2017)。目前,科研人员已经做出了大量的努力,利用数学模型(Biggs et al., 2009;Holling,1973;May,1977;Scheffer et al., 2009)、古生态群落的重建(Bruelet al., 2018;Kong et al., 2017;Mcgowan et al., 2005;Wang et al., 2012)以及种群和全湖水平实验(Carpenter et al., 2011;Faassen et al., 2015)来理解稳态转换。然而,几乎没有直接的证据来证实自然生态系统的非线性变化(Capon et al., 2015年),因为监测计划通常受到时间序列长度短和采样分辨率低的限制。虽然也可以利用野外观测中的空间替代时间方法(Su等,2019a;van Nes & Scheffer,2005;Ward et al., 2018)或遥感档案(Staver et al., 2011;Xuet al., 2016)间接检测稳态转换,但空间数据往往具有不同的时间背景,无法提供特定地点的变化机制。
生态恢复力是指生态系统在面对扰动时维持其结构、功能和过程的能力(Holling,1973年)。理论表明,预警信号(EWS)可用于监测生态系统在接近阈值时空间和时间行为的微妙变化(Carpenter & Brock,2006;Clements & Ozgul,2018;Dakos et al., 2012;Guttal & Jayaprakash, 2008;Kefi et al., 2014;Scheffer et al., 2009)。这些预警信号指标多基于临界慢化(critical slowing down, CSD)现象,其特征是当一个生态系统接近突变的阈值时,小的扰动后恢复速率降低(Dakos等,2008)。预警信号表明生态恢复力丧失,即生态系统变得更加脆弱,更容易转向其他状态。突变前系统中方差和自相关的增加已在理论和实验上得到证明(Carpenter & Brock,2006;Spears et al., 2017),为描述恢复力的动态提供了一种理想的方法。复合预警指标近年来也被提出,通过结合多个指标来提高整体预测能力(Drake & Griffen,2010)。此外,在复合预警指标中包含性状信息(如个体大小),比单独基于丰度的传统时间序列指标提供更稳健的预测(Arkilanian,Clements,Ozgul,& Baruah,2020;Baruah,Clements,& Ozgul,2020;Clements,Blanchard,Nash,Hindell,& Ozgul,2017;Clements & Ozgul,2016)。然而,大多数关于生态恢复力和/或预警信号的研究都集中在环境的恶化上,而恢复过程中的生态恢复力受到的关注较少(但见Clements et al., 2019)。
气候变暖、富营养化和鱼类放养是破坏水生生态系统功能的三个主要人为因素(Daskalov et al.,,2007;Moss et al., 2003;Smith和Schindler,2009)。例如,气候变暖可诱发食物网中的物候不匹配(Durantet al., 2007;Schweigeret al., 2008;Winder & Schindler, 2004),改变消费者的觅食行为(Woodward et al., 2010),并降低水生生物的个体大小(Forsteret al., 2012;Yvon-Durocheret al., 2011),这可能会改变维持稳定状态的反馈机制和生态系统对干扰的恢复力(Wernberg et al. , 2010)。此外,气候变暖和鱼类放养可能通过生态网络以协同的方式相互作用(Christensen等,2006;Jackson et al., 2016),放大了下行效应的强度。因此,弄清多种压力源如何相互作用对生态系统的结构和功能的影响,对理解生态行为的动态至关重要。
浮游生物群落丰度和个体大小是重要的生态属性,可用于探索水体透明度下降的机制。个体大小是连接食物网结构和稳定性的重要物种性状(Brose等,2019;Spanbauer等,2016)。这一指标与能量需求、张口大小和生活史有关,它在决定营养级联的强度方面起着至关重要的作用(Delong et al., 2015)。之前的研究表明,营养物质上行效应主要影响浮游生物的丰度,而群落组成和体型分布主要由鱼类的下行效应决定(Lemmens et al., 2018)。水体的透明度不仅与浮游植物的丰度相关,而且与个体大小紧密相关。在相同的生物量条件下,一般认为悬浮颗粒较小的系统,水的透明度较低(Bhargava & Mariam, 1991)。由于自然界中的生态系统往往同时受到多种胁迫因素的影响(Crain,Kroeker,& Halpern,2010),上行效应和下行效应相对重要性的变化可能会使营养物质和生物过程之间的关系解偶联,从而导致生态系统在恢复过程中对营养物质的削减产生时滞。
中国科学院水生生物研究所东湖生态站科研人员利用跨越64年(1956-2019)的监测数据和沉积物重建的微化石记录(亚热带浅水湖泊——东湖,图1),提供了生态系统水平上的突变和时滞的实证定量证据。然后,我们评估了基于性状的复合预警指标是否能在崩溃和恢复之前可靠地检测到,并探究了复合预警信号在崩溃/恢复之前需要的时间序列数据。揭示了气候变暖、鱼类放养和富营养化如何相互作用推动生态系统非线性响应的机制。研究认为,主导驱动因素从上行效应到下行效应的转变造成了时滞,阻碍了恢复过程营养物质削减的努力。
2. 材料和方法
东湖(北纬30°33′02″,东经114°21′40″)是长江中下游平原的亚热带浅水湖泊,位于湖北省武汉市,是一个城市中心湖(图1)。东湖平均水深2.21 m,湖面面积32 km2。本研究基于武汉东湖长期监测数据(1956-2019年)及古硅藻化石记录对生态系统稳态转换进行了交叉验证。
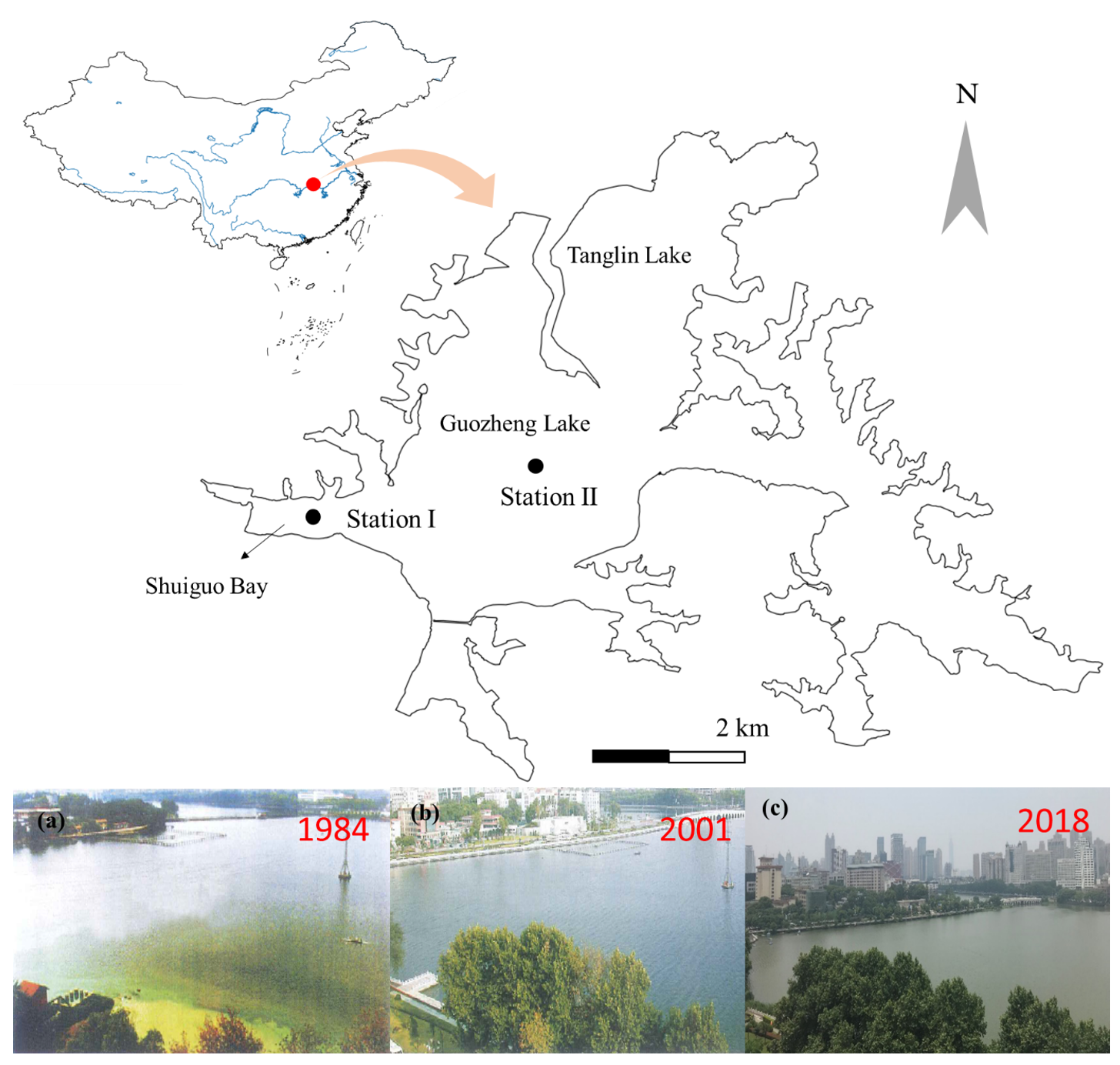
图1. 武汉东湖
3. 研究结果
3.1 多个状态变量的突变
在1980年代中期,武汉东湖经历了从清水状态转变为以浮游植物为主的浊水状态。多个生物和非生物 "状态变量 "均发生了突变。具体而言,我们选择了10个全面代表生态系统生物和非生物因素的状态变量,如水体透明度在1985年出现突变后,均值从1.77 m下降到0.86 m(图2,左栏)。此外,近几十年来,东湖的环境压力越来越大。年平均气温显著升高,鱼类放养密度也有显著增加,水体中的TN也显著增加,但TP变化不显著。
3.2 恢复过程中的时滞
通过绘制这些相同的状态变量--即水的透明度、浮游植物总密度、枝角类密度、浮游植物和枝角类的个体大小--作为环境胁迫的响应变量,我们揭示了一个折叠的分叉,这表明存在时滞的特征(图2,右栏)。当外界环境压力在-0.21和0.08之间的值范围内时,生态系统处于清水或浑浊状态。湖泊生态系统崩溃和恢复过程的轨迹不同,表明湖泊恢复过程时滞的存在(图2,右栏)。
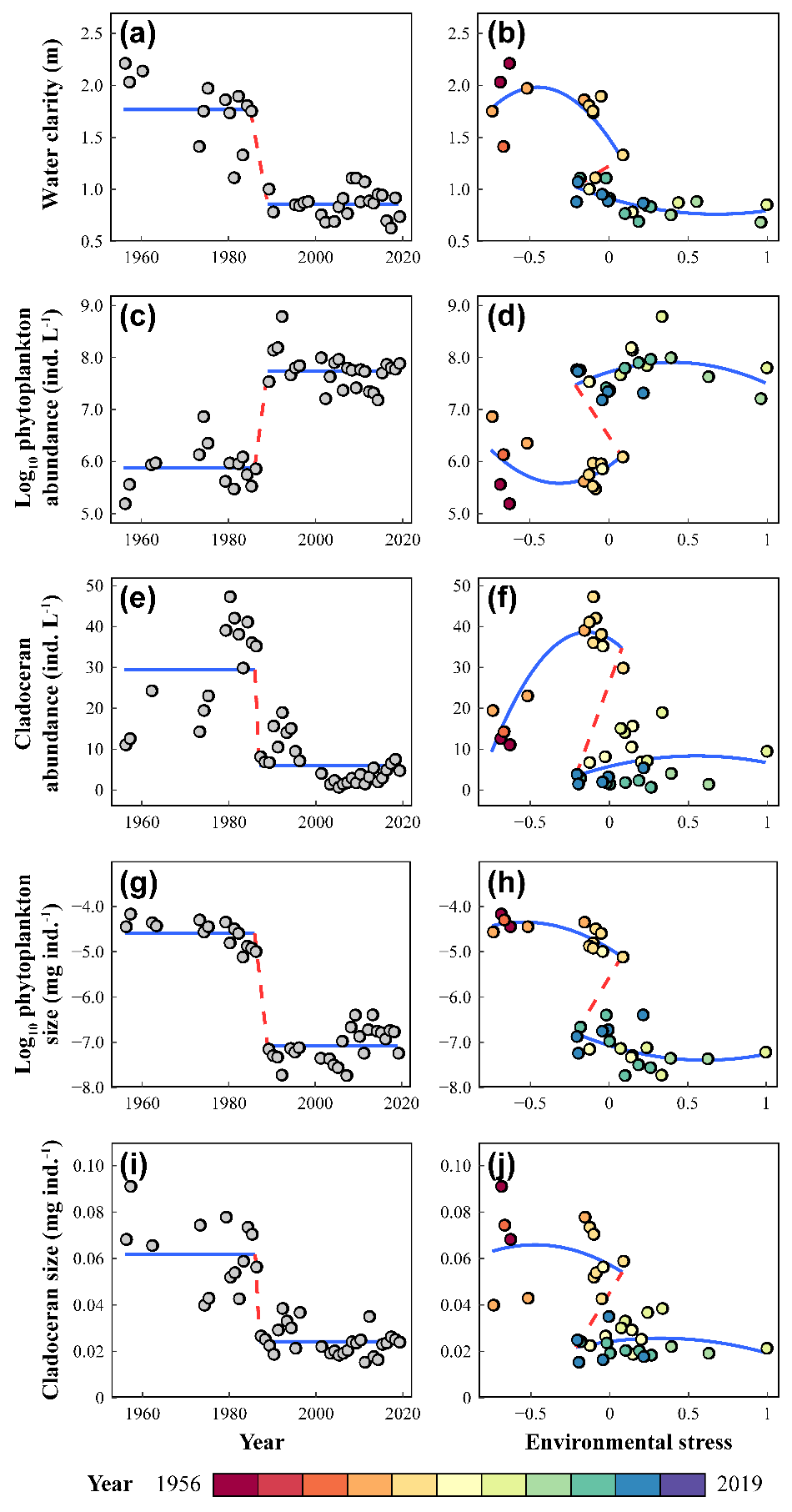
图2. 东湖生态系统多响应变量的突变(左栏)与时滞(右栏)
3.3 从古硅藻记录中得到政权转移的证据。
我们从沉积物岩芯中提取的古硅藻记录也检测到了突变的存在(图3),并与长期生态监测数据中发现的模式一致。具体而言,1984年以前(49-16cm)硅藻群落以浮游生物Aulacoseira granulata为主,平均丰度为60.6%。1984年后(16-0 cm),A. granulata迅速减少,Stephanodicus minutulus成为优势种。而常附着于水下大型水生植物的Eunotia sp.、Epithemia sorex和Gyrosigma accuminatum等类群,在80年代中期后呈下降趋势。
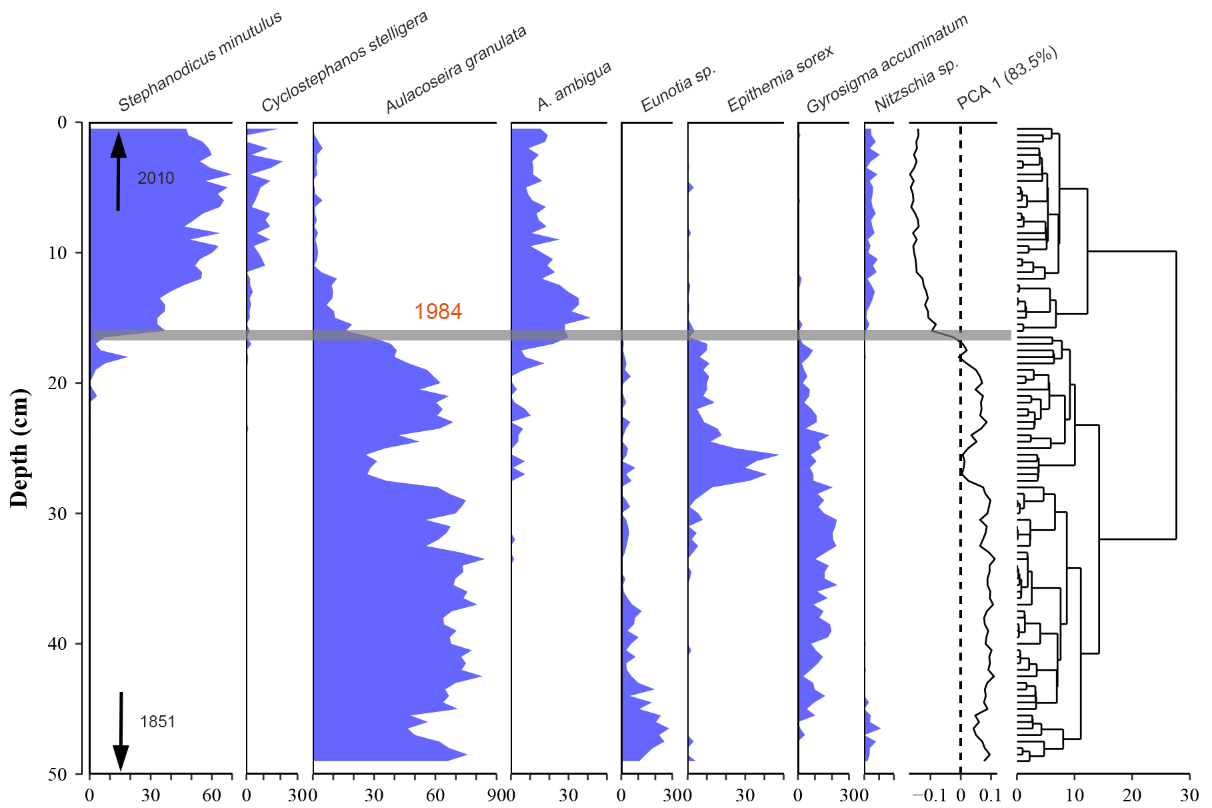
图3 东湖古硅藻化石记录
3.4 EWS分析
综合预警指标的最大值大于2σ的阈值,表明在崩溃和恢复的轨迹中,不同的生物(浮游植物、枝角类和古硅藻类)都存在预警信号(图4a,c)。此外,包括个体大小信息的综合指标一般所需的数据长度更小以及具有较高的预测比例。也就是说,包括个体大小信息的综合预警信号比只基于丰度的预警指标在崩溃和恢复轨迹中都有更强的预测能力(图4b,d)。
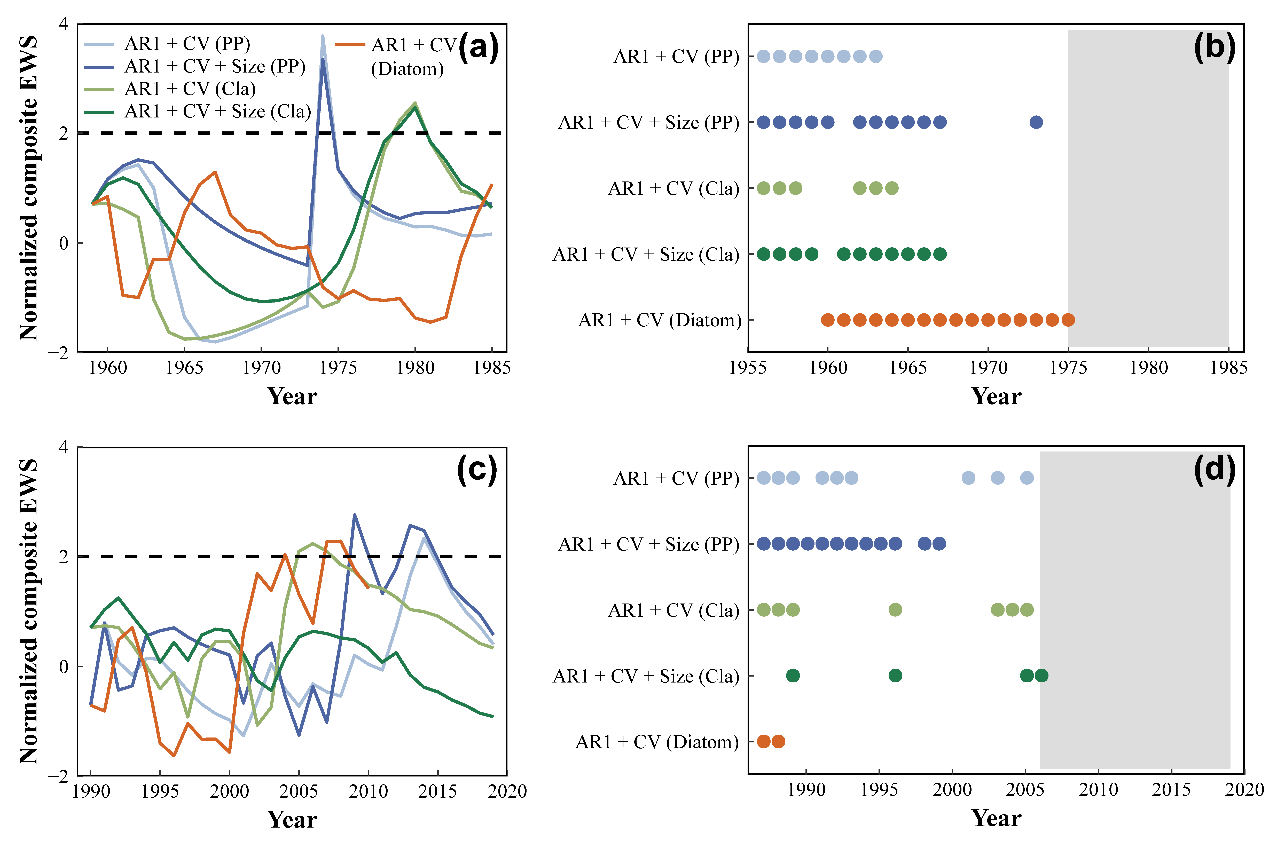
图4综合预警指标在(a,b)崩溃和(c,d)恢复之前的变化。
3.5 多重因素促使生态系统进入浑浊状态
Theil-Sen回归结果显示,鱼类产量和温度均与水体透明度和枝角类浮游动物丰度呈负相关,与浮游植物总密度呈正相关。此外,鱼类产量和温度与浮游植物个体大小和枝角类个体大小呈现负相关关系(图5)。有趣的是,尽管鱼类和气候变暖对甲壳类浮游动物有负面影响,但在稳态转换之前,枝角类丰度却呈上升趋势。此外,我们发现TN和TP与总初级生产力、轮虫丰度、桡足类丰度和枝角类丰度显著正相关,而这些关系在稳态转换后减弱或消失。这些结果表明,上行效应在清水态占主导地位,而下行效应在浊水态占主导地位。
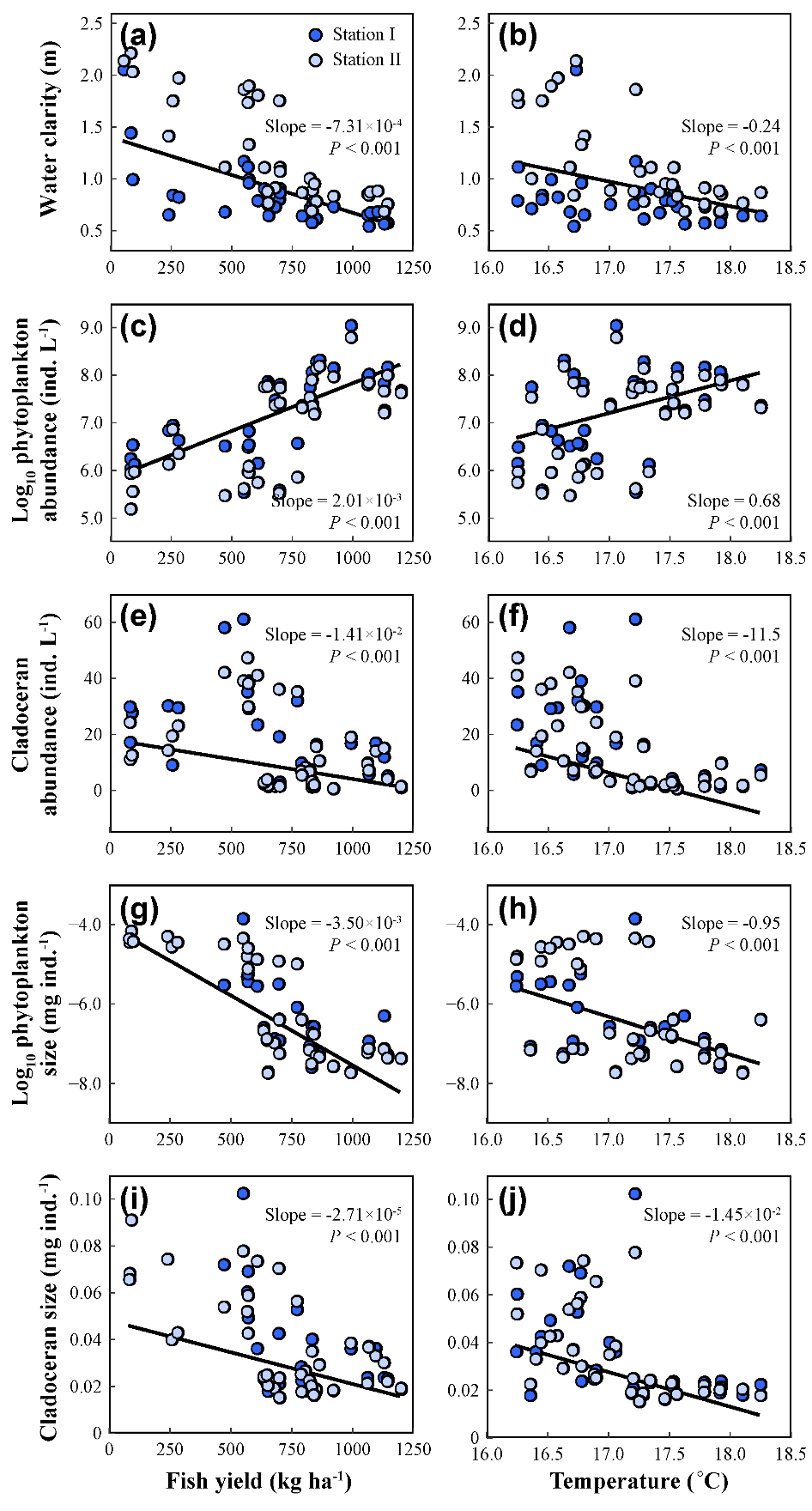
图5 鱼类和温度与系统各响应变量的关系
4. 讨论
近几十年来,稳态转换或多稳态概念(Marten Scheffer等人,2001年)得到了很多关注,它可以发生在多种生态系统类型中,例如湖泊、海洋、珊瑚礁和干旱地等。然而,之前的一项研究回顾了135篇关于淡水生态系统的论文,并表明在自然生态系统中几乎没有经验证据来证实压力诱导的非线性变化(Capon等,2015)。一般认为,稳态转换应该发生在整个系统层面,变化可以在多个物理和生物成分中检测到,包括重建的古生物群落(Dong,Kattel,& Jeppesen,2020;Kong等,2017;Zhang等,2018)。虽然重建微生物化石记录的方法受到低分辨率和少数类群的限制,但古生物可以提供长期的参考数据来跟踪生态系统的动态。在本研究中,我们提供了交叉验证的多学科证据,以验证系统在多营养级和水环境中的突变,以及在一定环境条件下多稳定状态的存在。
4.1崩溃和恢复前的预警信号检测
在多种人为压力下,全世界的生态系统正面临着生物多样性丧失和生态系统功能退化的问题。因此,预测生态系统的崩溃(前移)和恢复(后移)是一个关键的挑战,因为它关系到管理成本和保护效率。前人已经做出了许多努力来预测稳态转换;然而,预警信号是否可以在现实世界的恢复过程中被检测到,在很大程度上被忽视了。尽管Clements等人(2019)利用海洋鱼类捕捞数据在恢复过程观察到了预警信号,但尚未在自然淡水生态系统中进行检测。在本研究中,发现在崩溃和恢复过程中的突变之前,可以检测到预警信号。虽然我们尚未观察到系统完全恢复,但预警信号表明维持浊水状态的弹性正在丧失,这表明东湖正处于恢复中。我们还发现,在复合预警指标中包含个体大小信息可以更稳健地预警生态系统结构和功能的突然变化(Clements等人,2017;Clements & Ozgul,2016)。由于硅藻系列数据的上限是2010年,硅藻的复合预警指标(AR1+CV)比浮游植物和枝角类的复合预警指标对恢复具有较低的预测能力,表明系统越接近临界点,预警信号的预测能力越强。我们的结果表明,即使在没有观察到完全恢复的情况下,预警信号也可以被检测到,这为我们采取措施恢复清水生态系统提供了机会。在管理实践中,除了减少营养物质外,还需要采取更多的积极措施(如降低鱼类放养密度和种植大型沉水植物),以促进恢复到沉水植物为优势的清水状态。
4.2突变和时滞的机制
这项研究包括了多种压力源和营养级的数据,这使我们能够探索各营养级之间的相互作用,并揭示整个生态系统中突变的机制。多种人为胁迫因素可能会产生正反馈,在湖泊生态系统中引发不可预知的 "生态意外"(Birk等,2020;Davis,Sim,& Chambers,2010;Jackson等,2016)。例如,草食和附生生物遮蔽的协同效应会引发大型水生植物的衰退和稳态转换(Hidding,Bakker,Hootsmans,& Hilt,2016)。本研究中气候变暖和鱼类放养带来的级联效应对水体透明度有直接和间接的负面影响(图5),共同推动生态系统进入浑浊状态,并使营养物质和生物成分之间的关系解偶联。浮游植物的个体小型化和浮游植物密度上升可能是理解水体透明度下降的关键,因为漂浮在水体中的小型浮游颗粒具有较高的比表面积,可以更有效地散射和反射光线。反过来,透明度的下降又会对大型水生植物产生负面影响,形成一个正反馈循环,即 "水越浑浊,大型水生植物越少"(Su等,2019b;van der Heide,van Nes,van Katwijk,Olff,& Smolders,2011;本研究,图6)。
了解时滞的机制对管理实践至关重要。有人认为,水体透明度低、鱼类或鸟类放牧、水位波动以及沉积物中缺乏繁殖体或种子等因素,都会阻碍恢复到以大型植物为主的生态系统(Hilt等人,2006)。在本研究中,我们提出了一个三维概念模型来形象地描述临界过渡和滞后的机制(图6)。在向前的上行效应占主导的系统中,根据湖泊的双稳态理论,富营养化有利于初级生产者,从而降低水的透明度。在向后的恢复轨迹中,鱼类驱动的下行效应控制着生态系统的行为,因而即使营养水平降到生态系统崩溃的数值以下系统依然不能恢复。由于呼吸作用比光合作用对变暖更为敏感(Allen et al., 2005;Yvon-Durocher et al., 2010),温度上升会增加代谢率和资源需求,因此会增强下行效应的强度(Kratina et al., 2012)。此外,有研究表明,鱼类放养和气候变暖都会增加水体营养物质的可利用性,如通过鱼类直接排泄、沉积物中营养盐释放、矿化率增强和蒸发量增加等(Domis等,2013;Gudasz等,2010),进一步削弱了营养盐削减的效果。此外,食物网可能会对下行效应表现出进化反应(例如,枝角类种群的基因型频率),使恢复过程变得缓慢甚至不可能(Kuparinen和Merilä,2007年;Stokes和Law,2000年)。

图6 表示东湖生态系统清水状态(左,20世纪80年代中期以前)和浊水状态(右,20世纪80年代中期以后)特征的信息图。与植被丰富的清水状态相比,浊水状态的特点是水下大型水生植物消失,水体营养浓度高,鱼类放养密度大,甲壳类丰度低,浮游植物密度大,浮游动物和浮游植物体型较小。一张示意图概括了鱼类放养、气候变暖和富营养化是如何影响水体透明度和水下大型植物之间的反馈的。红色箭头代表正效应,黑色箭头代表负效应,灰色虚线箭头代表不显著的路径。箭头宽度与关系的强度成正比。箭头上方的数字表示路径系数。模型拟合总结:χ 2=10.83,df=7,P=0.146。上图中的三维概念模型显示了富营养化、鱼类放养和气候变暖等不同压力情景下的生态系统行为。营养限制的自下而上效应在前向清水体制下占主导地位,而自上而下的级联效应在后向浊水体制下占主导地位。随着鱼类放养密度和温度的增加,压力响应的滞后性增加(用较低的恢复阈值表示)。此外,鱼类放养和升温可能产生的协同效应将进一步加强滞后性,湖泊恢复工作(如减少营养物质)的效果将因此而降低。
5. 结论
我们通过长期监测和重建古硅藻数据进行交叉验证,提供了亚热带浅水湖泊稳态转换的令人信服的实证证据。在气候变暖、富营养化和鱼类放养等综合压力下,东湖生态系统从沉水植物为主的清水状态转变为浮游植物为主的浊水状态。我们发现,在前向崩溃和向后恢复的轨迹中都可以检测到预警信号,而且在综合预警指标中包含个体大小信息对于评估系统接近临界点时的生态恢复力更为稳健。在一个多驱动因素控制的生态系统中,稳态转换后主导驱动因素由上行效应转变为下行效应,降低了浊水状态中营养盐削减的有效性。因此,在实践中,除了减少营养物质外,降低鱼类放养密度、减缓气候变暖、种植大型沉水植物等更多积极的管理措施,对于预期恢复到清水状态十分重要。